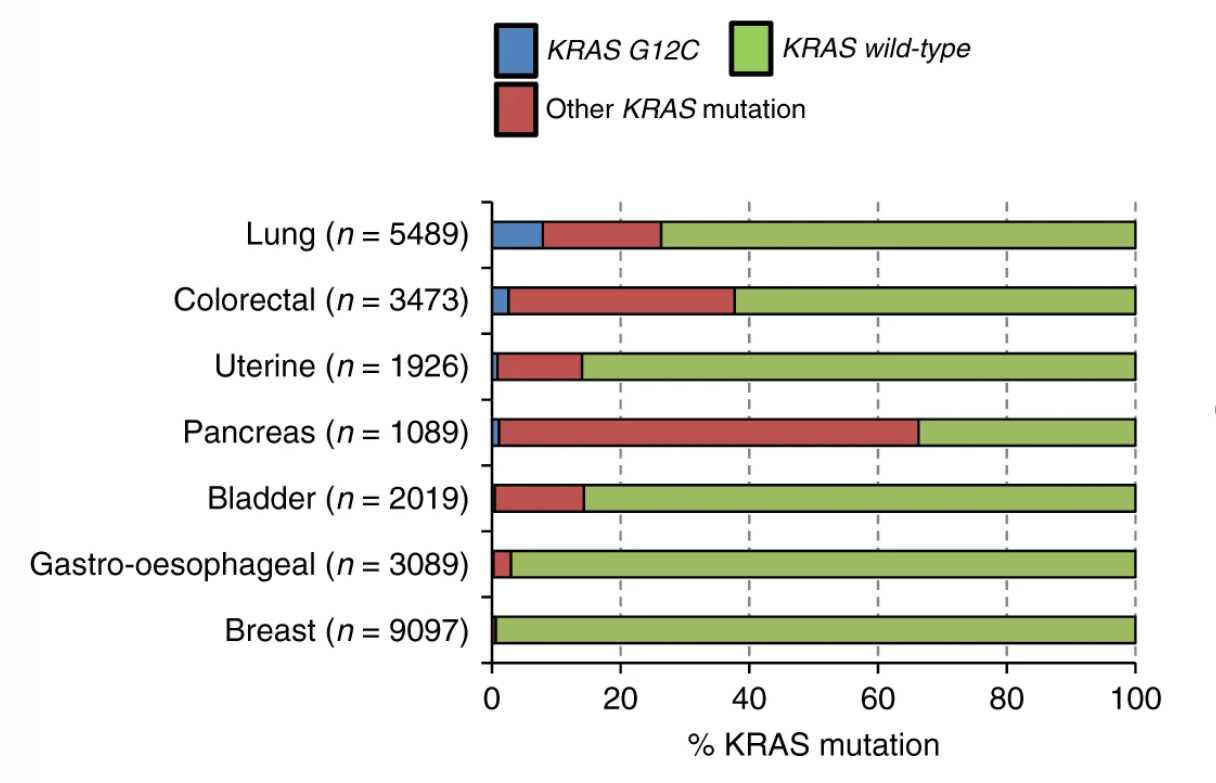
题图说明:KRAS G12C mutation in cancer, showing proportions of G12C and non-G12C KRAS mutations in seven cancers with the most KRAS G12C cases. Credit to Journal of Cancer volume 121, pages197–198 (2019)
美国FDA批准加速批准索托拉西布用于KRAS G12C突变的非小细胞肺癌(NSCLC)患者治疗。
几十年来,研究人员已经知道KRAS基因的有害突变是相当一部分癌症患者肿瘤发生的根本原因。尽管业界进行过无数次的尝试,一直没有有效的治疗方法来对抗突变的KRAS蛋白。2021年5月28日,美国食品和药物管理局加速批准了RAS GTP酶家族抑制剂sotorasib(Lumakras™,安进公司)用于经FDA批准的检测所确定的原发灶晚期或转移性非小细胞肺癌(NSCLC)成人患者,这些患者之前至少接受过一次系统治疗。
这是肿瘤药物研发领域的一个重大突破。多年来,KRAS被认为是一个不可成药的 靶标。但对该蛋白生物学的进一步理解,以及技术进展,使曾经看似不可能实现的KRAS抑制剂的目标成为现实。
FDA还批准了QIAGEN therascreen® KRAS RGQ PCR试剂盒(组织)和Guardant360® CDx(血浆)作为Lumakras的伴随诊断产品。如果在血浆标本中没有检测到突变,则应检测肿瘤组织。13% 的非鳞状 NSCLC 患者肿瘤携带 KRAS G12C 突变。
获批基于CodeBreaK 100临床试验,这是一项多中心、单臂、开放标签临床试验(NCT03600883)。该研究包括124名以前接受过其他治疗的携带KRAS G12C突变的NSCLC患者。在这项临床试验中,索托拉西布使36%的参与者的肿瘤缩小,这些肿瘤反应持续时间中位数为10个月。相比之下,标准疗法仅能让20%的NSCLC患者的肿瘤缩小,而且这些效果通常是短暂的。